ページ内のコンテンツ一覧
眼感染症の検査方法について
当院では、PCRを応用して開発されたマルチプレックスPCR検査(多項目迅速PCR検査)やブロードレンジPCR(細菌・真菌全般の遺伝子領域を増幅させるPCR検査)等、様々な検査方法をご利用いただけます。こちらでは、各検査方法の解説や代表的な症例等について、ご紹介いたします。
- サンプル調整からPCRにかかる所要時間は2時間以内と迅速であること
- リアルタイムPCRを組み合わせて定量できること
- 20項目以上の抗原DNAの陽性か陰性かの判定が同時に可能であること
- 複数の抗原DNAが検出される可能性がある疾患(眼表面炎症性患者、免疫不全患者)に有用であること
- 眼科検体は常に微量のため検体量の少ないこの領域では極めて有用であること
このマルチプレックスPCRを新規にリニューアルしたPCR検査「ストリップPCR検査」を開発し、複数の報告をしてきました。検体(前房水、硝子体液、角膜擦過物、涙液など)を送って頂いて検査を行う事が可能になっています。ぶどう膜炎だけではなく眼内炎や角膜炎、角膜移植(ドナーを含む)の検体も検査可能です。
検査依頼について
ご依頼手順
まずは以下のメールにてお問い合わせ下さい。
詳細な検体の提出方法や検査費用等を記載した書類をお送りいたします。
各種検査方法
リアルタイムPCR検査(Real-time PCR検査)
リアルタイムPCR検査(Real-time PCR検査)は下記の24項目の病原微生物DNAの同定を各項目毎に、迅速に短時間でその遺伝子の定量(検体内のコピー数を知る事)ができます。
定量PCR 24項目
- HSV1
- HHV7
- 梅毒
- 細菌16S
- HSV2
- HHV8
- 結核
- 真菌28S
- VZV
- トキソプラズマ
- クラミジア
- アクネ菌
- EBV
- トキソカラ
- バルトネラ
- カンジダ
- CMV
- ADV
- フザリウム
- アスペルギルス
- HHV6
- クリプトコッカス
- アカントアメーバ
- HTLV1 proviral DNA
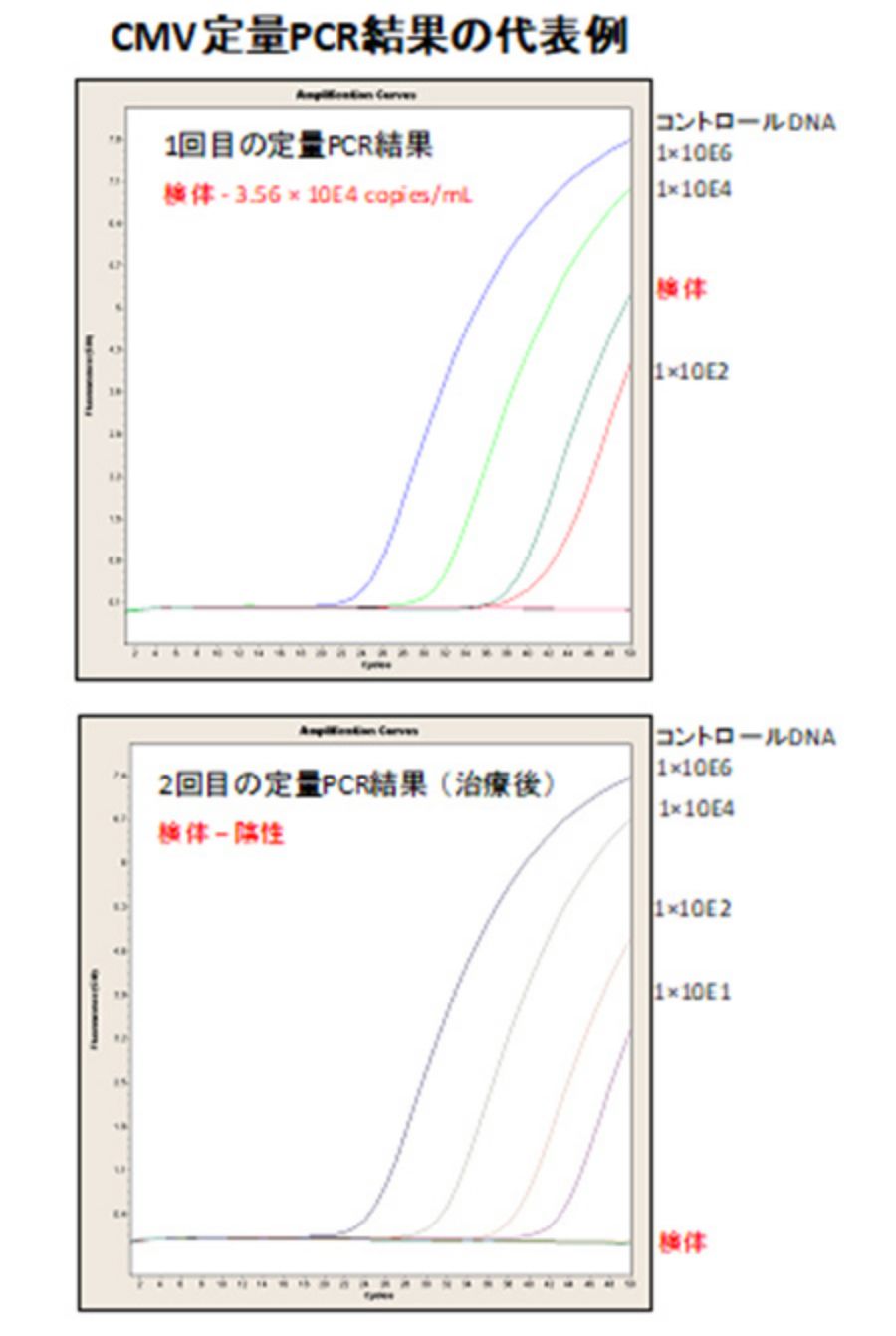
ストリップPCR検査で陽性になった項目はこのリアルタイムPCRを行います。また、細菌種(16S rDNA), 真菌種(18S/28S rDNA)などはブロードレンジPCRを組み合わせて眼局所のDNAコピー数を測定しています。検体内のコピー数を知る事ができて治療効果の判定に使用できます(以下、代表例)。
ブロードレンジPCRとは
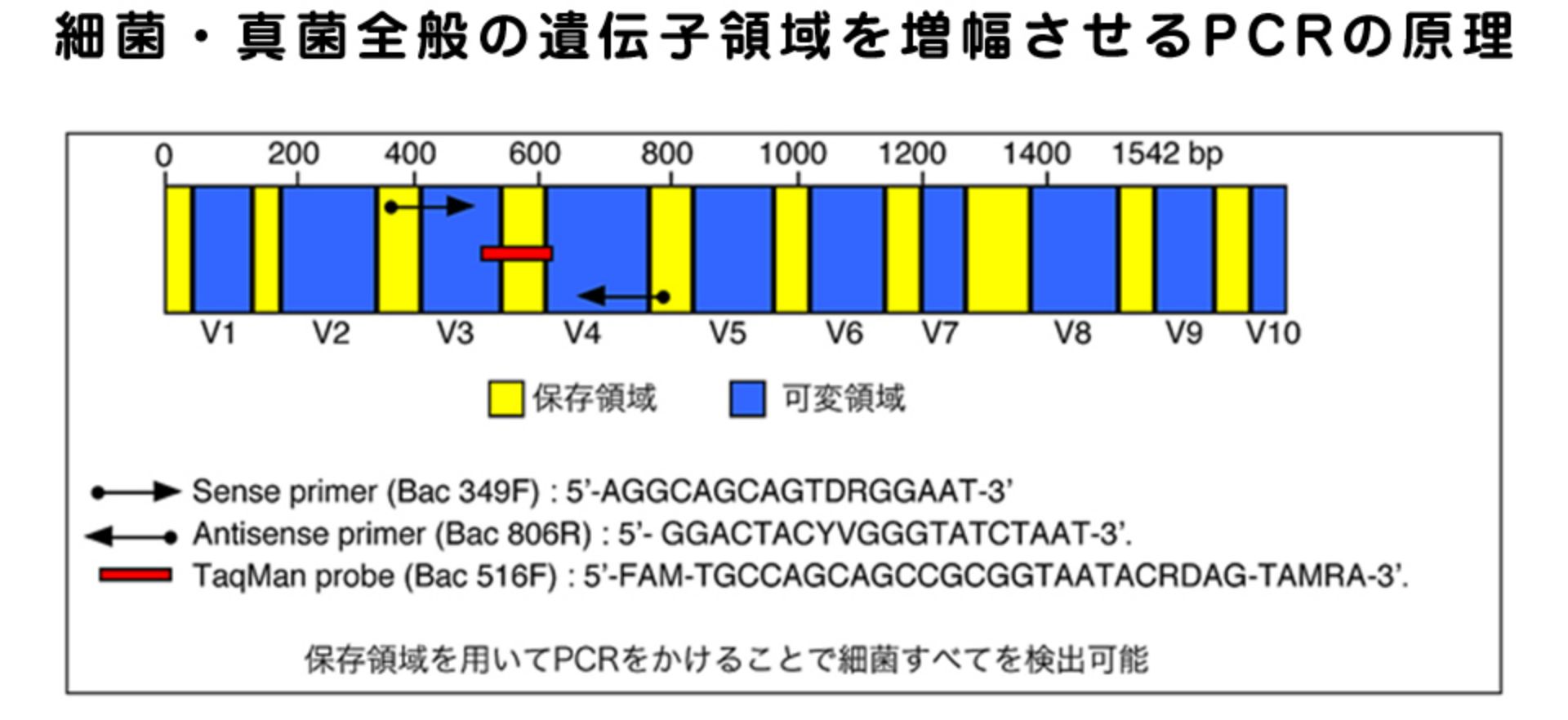
ブロードレンジPCRは、リボゾーマルRNA (rRNA) 遺伝子を標的にしたPCRで、原核生物では16S rRNA、真核生物では18S/28S rRNAといったそれぞれの種で保存された遺伝子を標的にしたものです。
ほとんど細菌が保有する遺伝子であるハウスキーピング遺伝子、16S rRNA(リボゾームの蛋白合成に関与、真菌の場合は18S/28S)はよく用いられるハウスキーピング遺伝子の一つで、これを検出することで菌の局所での存在(=感染)が証明できます。眼科領域でもこのブロードレンジPCRを用いて、検体から細菌や真菌を迅速に検出できるようになりました。
我々はこのブロードレンジPCRとリアルタイムPCRを組み合わせて眼局所の細菌・真菌DNAコピー数を測定しています。このプライマーのデザインでヒトに感染する細菌種の約70%を網羅すると考えられ、我々の過去の報告では、眼内炎の主な細菌(Sugita S, et al, Br J Ophthalmol. 2011; Ogawa M, et al. Jpn J Ophthalmol. 2012)および真菌(Ogawa M, et al. Graefes Arch Clin Exp Ophthalmol. 2012; Sugita S, et al. Graefes Arch Clin Exp Ophthalmol. 2012)を網羅した検査系になっています。
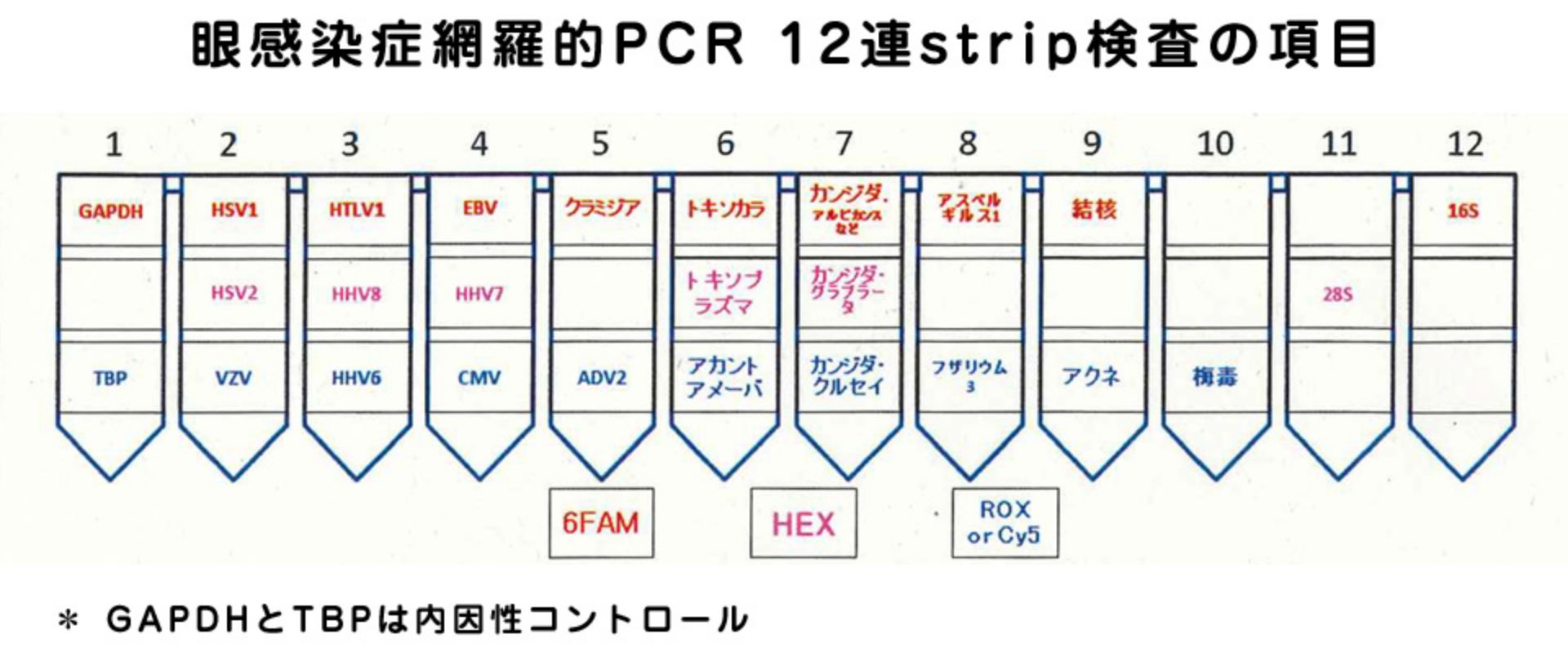
ストリップPCRとは
ストリップPCR検査(strip PCR検査)は下記の24項目の病原微生物DNAの同定を24項目同時に、迅速に短時間で陽性か陰性かの判断が可能です。原因不明の眼感染症が疑われる症例にお勧めです。スクリーニング検査として使用されています。
これにより感染性ぶどう膜炎の診断だけでなく多くの眼感染症を同定・否定することが可能です。
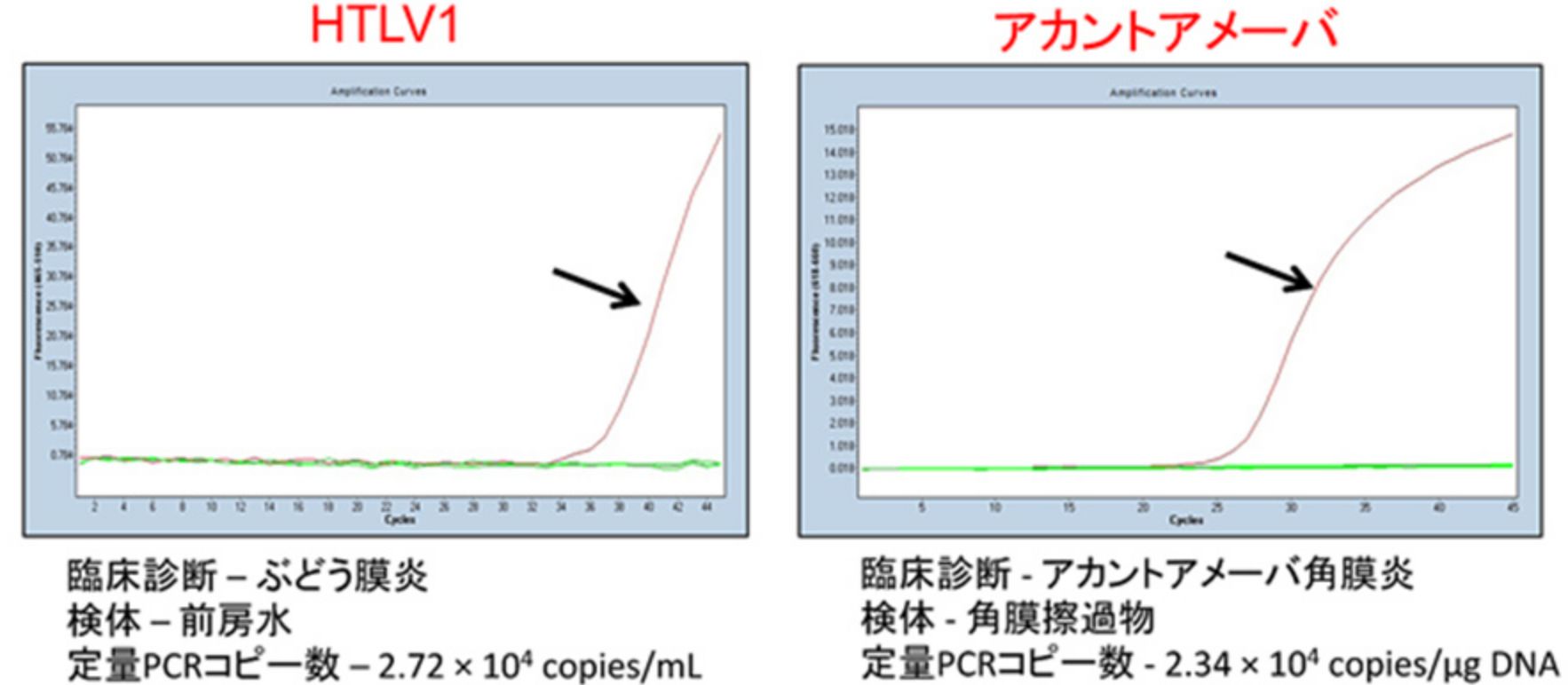
ストリップPCR検査で陽性と判定された代表症例
HTLV1-DNA、アカントアメーバDNAがそれぞれ陽性で、また、同時に他の上記項目が全て陰性であると判定できます。
感染性眼内炎strip PCR検査とは
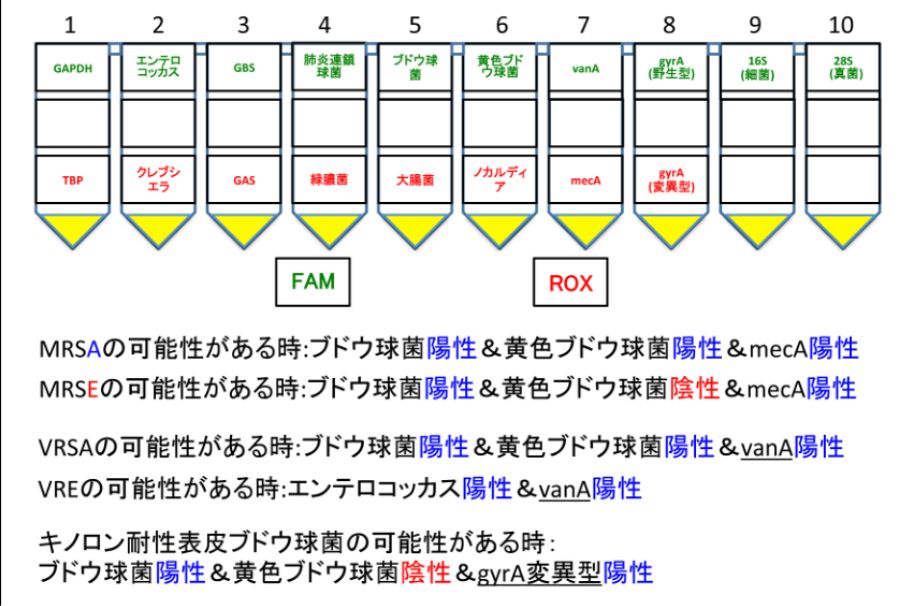
PCRを用いた細菌の検査は、16S全般を検出するものしかありませんでしたが、我々は東京医科歯科大学や大分大学協力のもと以下のような個々の細菌種を検出できるPCR検査を開発しました。
特に、感染性眼内炎で同定される細菌種を設定しています。緑膿菌、肺炎球菌、大腸菌、MRSA、MRSE、GAS(A群溶連菌)、GBS(B群溶連菌)、クレブシェラなど網羅的に検査できます。加えて遺伝子レベルでの薬剤耐性も検出できます(例:メチシリン耐性、バンコマイシン耐性など)。基本的に感染性眼内炎患者の硝子体を用いたものをお勧めしますが、DNA(例えば、感染性角膜炎のDNA)を用いても検査可能です。項目には真菌全般28Sも含まれています。感染性眼内炎や感染性角膜炎の菌種同定に用いてください。
なお、原液検体が黄色に染まっていると測定不能になる可能性があり、その場合はDNA抽出を行います。
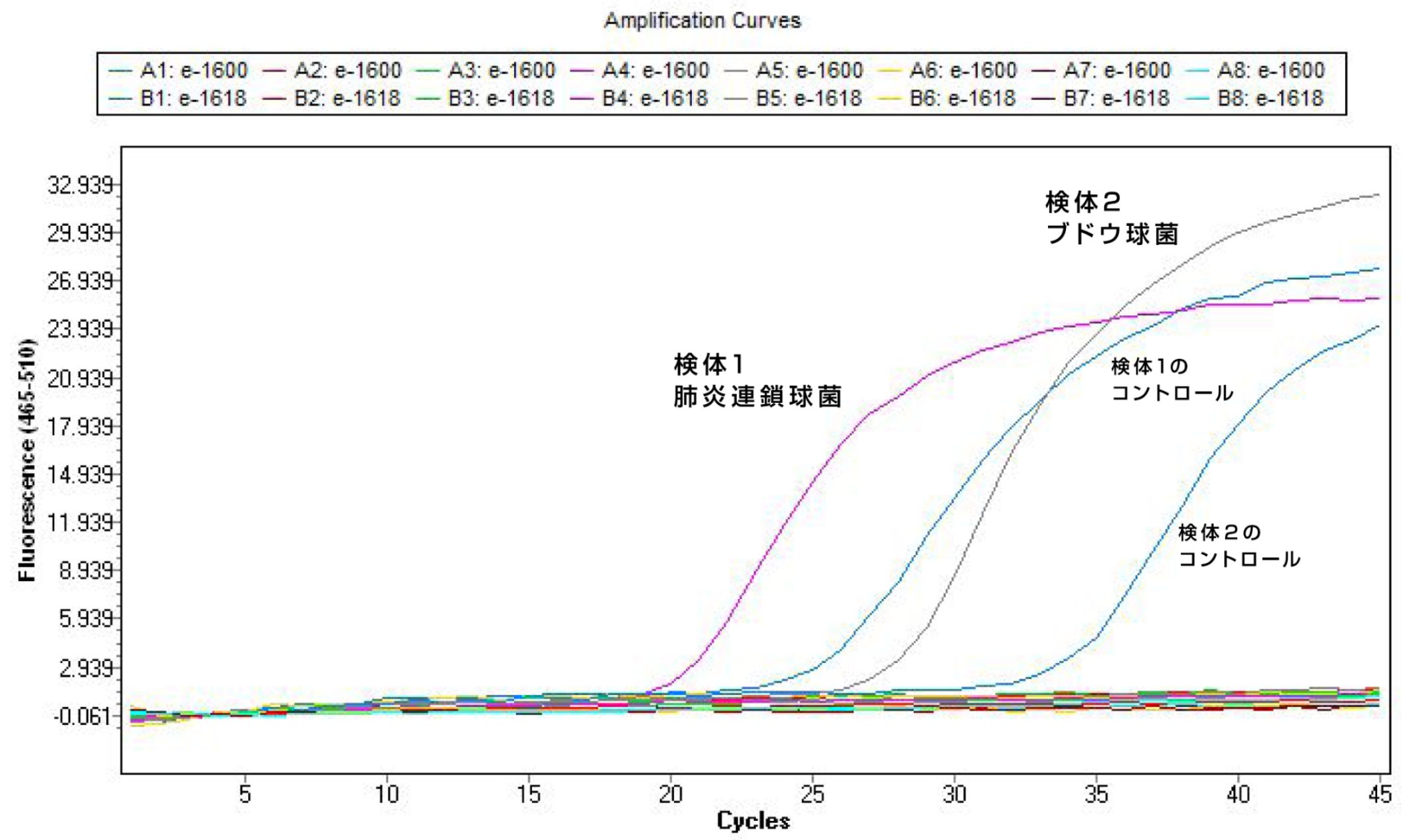
結果の代表例
検体1は肺炎レンサ球菌が検出、検体2はブドウ球菌が検出
代表症例
以下の4症例はこれらのPCR結果が診断に役立った代表例です。
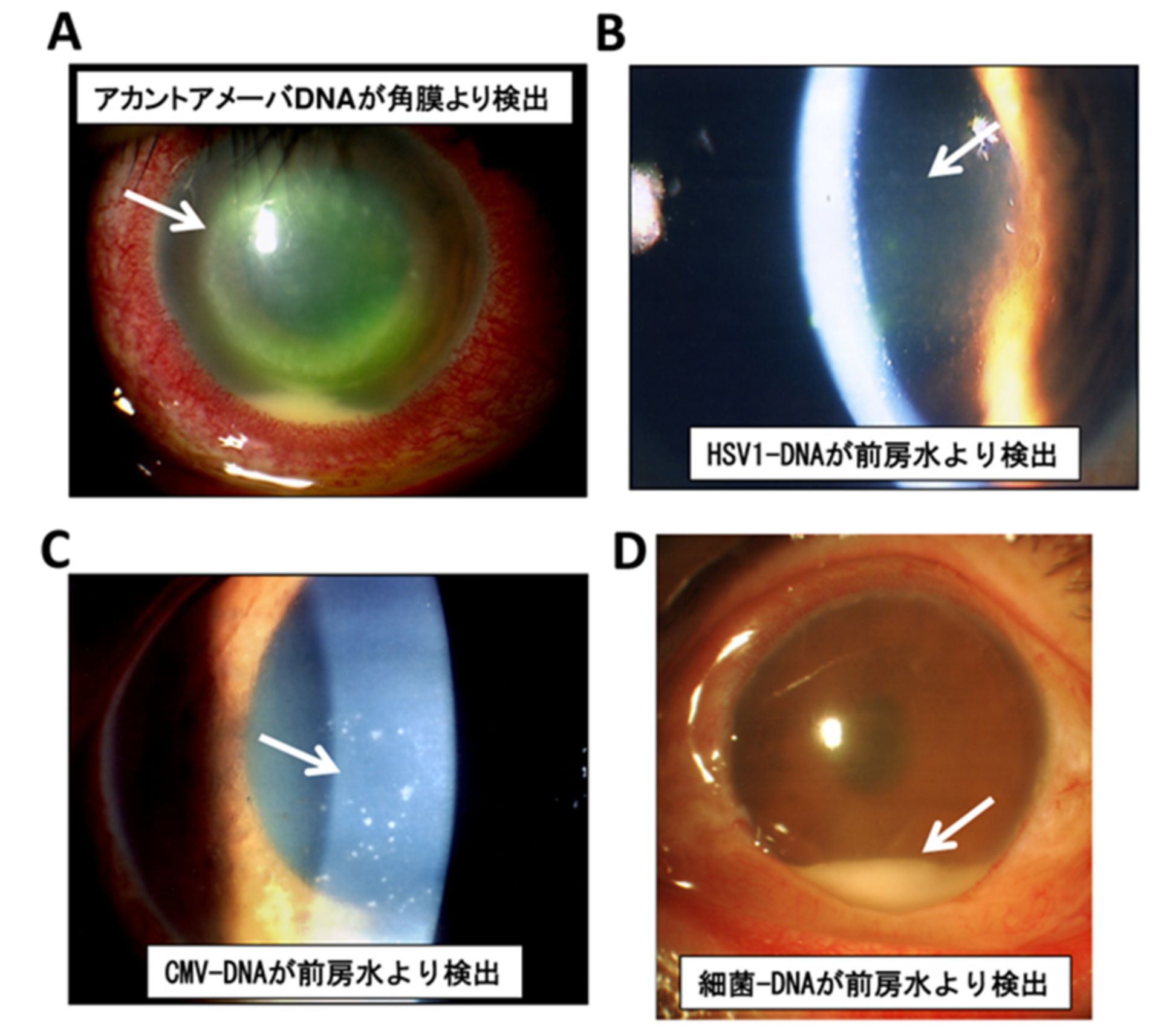
A. 原因不明の前房蓄膿を伴った角膜炎の症例。ヘルペス (HSV1など) は否定されアカント・アメーバが同定された。
B. 原因不明の角膜内皮浮腫および前房内細胞を伴った角膜内皮炎の症例。HSV1が同定された。
C. 原因不明の高眼圧症でポスナー・ショロシュマン症候群が疑われた症例。CMVが同定された。
D. 外傷後の前房蓄膿を伴った眼内炎の症例。細菌全般16S rDNAが同定。
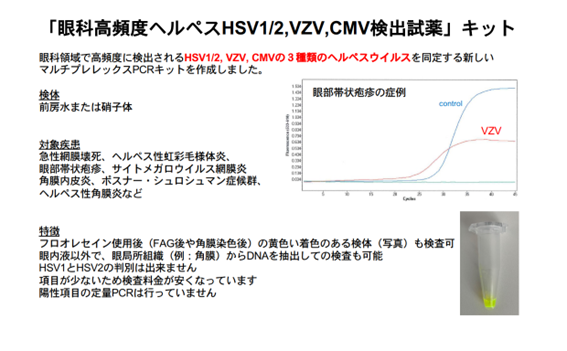
高頻度ヘルペスstripとは
HSV,VZV,CMVの3種類のヘルペスウイルスのみを短時間で陽性か陰性かの判断が可能となりました。
DNA抽出が不要かつ、プローブを工夫してFAG後などのフルオレセイン使用後の黄色の着色の検体も使用できます。
参考文献
マルチプレックスPCR論文
1. Sugita S, Iwanaga Y, Kawaguchi T, Futagami Y, Horie S, Usui T, Yamamoto S, Sugamoto Y, Mochizuki M, Shimizu N, et al. [Detection of herpesvirus genome by multiplex polymerase chain reaction (PCR) and real-time PCR in ocular fluids of patients with acute retinal necrosis]. Nihon Ganka Gakkai Zasshi. 2008;112(1):30-8.
2. Sugita S, Shimizu N, Watanabe K, Mizukami M, Morio T, Sugamoto Y, Mochizuki M. Use of multiplex PCR and real-time PCR to detect human herpes virus genome in ocular fluids of patients with uveitis. Br J Ophthalmol. 2008;92(7):928-32.
ブロードレンジ細菌・真菌PCR論文
3. Sugita S, Shimizu N, Watanabe K, Katayama M, Horie S, Ogawa M, Takase H, Sugamoto Y, Mochizuki M. Diagnosis of bacterial endophthalmitis by broad-range quantitative PCR. Br J Ophthalmol. 2011;95(3):345-9.
4. Ogawa M, Sugita S, Shimizu N, Watanabe K, Nakagawa I, Mochizuki M. Broad-range real-time PCR assay for detection of bacterial DNA in ocular samples from infectious endophthalmitis. Jpn J Ophthalmol. 2012;56(6):529-35.
5. Ogawa M, Sugita S, Watanabe K, Shimizu N, Mochizuki M. Novel diagnosis of fungal endophthalmitis by broad-range real-time PCR detection of fungal 28S ribosomal DNA. Graefes Arch Clin Exp Ophthalmol. 2012;250(12):1877-83.
6. Sugita S, Kamoi K, Ogawa M, Watanabe K, Shimizu N, Mochizuki M. Detection of Candida and Aspergillus species DNA using broad-range real-time PCR for fungal endophthalmitis. Graefes Arch Clin Exp Ophthalmol. 2012;250(3):391-8.
VZV 関連論文
7. Kido S, Sugita S, Horie S, Miyanaga M, Miyata K, Shimizu N, Morio T, Mochizuki M. Association of varicella zoster virus load in the aqueous humor with clinical manifestations of anterior uveitis in herpes zoster ophthalmicus and zoster sine herpete. Br J Ophthalmol. 2008;92(4):505-8.
EBV関連論文
8. Takahashi H, Sugita S, Shimizu N, Mochizuki M. A high viral load of Epstein-Barr virus DNA in ocular fluids in an HLA-B27-negative acute anterior uveitis patient with psoriasis. Jpn J Ophthalmol. 2008;52(2):136-8.
9. Yamamoto S, Sugita S, Sugamoto Y, Shimizu N, Morio T, Mochizuki M. Quantitative PCR for the detection of genomic DNA of Epstein-Barr virus in ocular fluids of patients with uveitis. Jpn J Ophthalmol. 2008;52(6):463-7.
CMV関連論文
10. Miyanaga M, Sugita S, Shimizu N, Morio T, Miyata K, Maruyama K, Kinoshita S, Mochizuki M. A significant association of viral loads with corneal endothelial cell damage in cytomegalovirus anterior uveitis. Br J Ophthalmol. 2010;94(3):336-40.
HHV6関連論文
11. Sugita S, Shimizu N, Kawaguchi T, Akao N, Morio T, Mochizuki M. Identification of human herpesvirus 6 in a patient with severe unilateral panuveitis. Arch Ophthalmol. 2007;125(10):1426-7.
12. Sugita S, Shimizu N, Watanabe K, Ogawa M, Maruyama K, Usui N, Mochizuki M. Virological analysis in patients with human herpes virus 6-associated ocular inflammatory disorders. Investigative ophthalmology & visual science. 2012;53(8):4692-8
トキソプラズマ関連論文
13. Sugita S, Ogawa M, Inoue S, Shimizu N, Mochizuki M. Diagnosis of ocular toxoplasmosis by two polymerase chain reaction (PCR) examinations: qualitative multiplex and quantitative real-time. Jpn J Ophthalmol. 2011;55(5):495-501.
多施設共同研究結果まとめ論文
14. Sugita S, Ogawa M, Shimizu N, Morio T, Ohguro N, Nakai K, Maruyama K, Nagata K, Takeda A, Usui Y, et al. Use of a Comprehensive Polymerase Chain Reaction System for Diagnosis of Ocular Infectious Diseases. Ophthalmology. 2013;120(9):1761-8
Strip PCRの代表論文
15. Nakano S, Sugita S, Tomaru Y, Hono A, Nakamuro T, Kubota T, Takase H, Manabu M, Takahashi M, Shimizu N. Establishment of multiplex solid-phase strip PCR test for detection of 24 ocular infectious disease pathogens. Invest Ophthalmol Vis Sci. 2017;58:1553-1559.
16. Nakano S,Tomaru Y,Kubota T,Takase H,Mochizuki M,Shimizu N,Sugita S,Strip PCR Project Group. Evaluation of a Multiplex Strip PCR Test for Infectious Uveitis: A Prospective Multicenter Study. Am J Ophthalmol.2020;213:252-259
PCR review論文
17. Mochizuki M, Sugita S, Kamoi K, Takase H. A new era of uveitis: impact of polymerase chain reaction in intraocular inflammatory diseases. Jpn J Ophthalmol. 2017:61:1-20.
角膜移植関連の代表論文
18. Hariya T, Maruyama K, Sugita S, Takahashi M, Yokokura S, Sato K, Tomaru Y, Shimizu N, Nakazawa T. Multiplex polymerase chain reaction for pathogen detection in donor/recipient corneal transplant tissue and donor storage solution. Sci Rep. 2017;7(1):5973.
眼腫瘍関連の代表論文
19. Usui Y, Rao NA, Takase H, Tsubota K, Umazume K, Diaz-Aguilar D, Kezuka T, Mochizuki M, Goto H, Sugita S. Comprehensive polymerase chain reaction assay for detection of pathogenic DNA in lymphoproliferative disorders of the ocular adnexa. Sci Rep. 2016;6:36621.
よくある質問
どの検査を行えばいいですか?
原因が不明の場合「12連strip検査」がお勧めです。
スクリーニング検査としてウイルス、細菌、真菌、寄生虫の多くを網羅できます。
前房水・硝子体・涙液・角膜擦過物はどのくらいの量が必要ですか?
また、涙液や角膜擦過物はそのままチューブに入れて提出すればいいですか?
前房水・硝子体は60μ以上(可能ならば100μ以上)あれば検査可能です。前房水の代表的な採取方法は添付1 ( zenbousui.pdf)に記載していますので参考にされて下さい。ただし、針付きのままは送付されないでください。チューブへ移すかシリンジに三活をつけて下さい。
涙液は希釈涙液をお勧めしています(参考:Eye wash法:「涙液の採取方法」 ruieki.pdf)。角膜擦過物などの眼組織は可能な限り、です。検体量が少ない場合DNAが取れずに検査不成立になる場合がありますのでご注意下さい。
角膜擦過物は清潔なチューブに乾燥しないように入れて送って下さい。なお、清潔なエッペンチューブ(1袋)を無料配布していますのでご希望の方はご連絡下さい。
検体は採取してからどのくらい4℃で置いておけますか?
前房水・硝子体など全ての検体が4℃(冷蔵庫)で1~2週間置いておけます。もしそれ以上の保管の場合は冷凍保存(-20℃)をお勧めします。夏場は検体の温度上昇にご注意下さい。
硝子体は灌流前の生検体がいいですか?あるいは灌流液でもいいですか?
硝子体は灌流前の生検体がいいですが、灌流液そのものを郵送して頂いても検査できます。
結果の判定・解釈に困っています。相談できますか?
HPを参考にしてもらっても結果の判定や解釈に困る場合はご相談下さい。(メール:e_pcrtest@kcho.jp)
EBV陽性結果でした。原因ウイルスと考えてよろしいですか?
眼感染症に付随して眼内組織に潜伏しているEBVが増幅していると推測されています。つまり主原因の事は少なく2次的な要因と考えられています。しかし他の外来性抗原が検出されず、また、EBV-DNAのコピー数が高い場合は主原因の可能性もあります。詳しくはHP内の参考文献をご参照下さい。また、HHV6も同じ様な病態と考えられています(参考文献参照)。
細菌や真菌陽性の結果はどの程度コンタミネーションが含まれるのでしょうか?
細菌種(アクネ菌を含む)や真菌種は常にこの問題がつきまといます。我々の検査室内ではコンタミ問題には特に配慮していて、こちらの検査中でのコンタミはないと思ってもらって結構です。ただ、検体採取時にコンタミするなどどの工程でコンタミするかは分かりませんので細菌や真菌陽性の結果はよく眼所見と照らし合わせて診断されて下さい(特に、コピー数が低い場合は注意が必要)。ご存知のように眼表面には常在菌がいますので眼表面検体(角膜、涙液)の結果はご注意下さい。
偽陰性の可能性が高い項目はどれですか?
偽陰性=PCR結果は陰性であったが何らかの眼感染症であるものを示しますが、特に注意が必要なのは、トキソカラおよび結核です。日本でのこれらの疾患はこれらの抗原に対するアレルギー反応程度と考えられていて他の検査の方が有効と考えられています。結核に関しては他の検査(ツベリクリン皮内テストやT-spot採血など)を参考に診断される事をおすすめします。これらの2つの疾患は、PCRは感度が良くなく結果は参考程度にされて下さい。
偽陽性の可能性が高い項目はどれですか?
偽陽性=PCR結果は陽性であったが眼感染症でないものを示しますが、特に注意が必要なのは、細菌種(アクネ菌を含む)や真菌種となります。コンタミなのか原因抗原なのかの解釈は上記の「偽陰性の可能性が高い項目はどれですか?」にも記載しています。参考にされて下さい。
覚書の甲欄の名前は担当医でいいでも構いませんか?
基本的には病院長様でお願いしておりますが、眼科長様のお名前でも構いません。
覚書・連絡票はFAXでも送信してもいいですか?
原本を郵送して下さい。覚書は押印していただいたものを2通送って下さい。1通は当院の押印をしたのち返送致します。
ヤマト運輸でしか発送してはいけないのですか?
指定の配送業者がある場合はヤマト運輸以外でも構いませんが、その場合は配送業者と問い合わせ番号を教えて下さい。ヤマト以外ですと直接研究室に届かないで事務に届く場合や運送業者によっては午前指定にされていましても午後2時や3時頃に届く場合も多々あります。そのため、基本的にはヤマト運輸でお願いしております。
(ヤマト運輸であっても道路状況や混雑する時期は遅れることがあります)
クール宅急便ではなく室温での発送(封筒に検体を入れるなど)はしてはいけないのですか?
4℃以上に温度が上がると検体の品質の保証ができません(特に、夏場)。
患者さんからコストは取れませんか?
取れませんのでご了承下さい。
この検査が先進医療と同じ内容と聞きました。同じ検査できますか?
感染性眼内炎が細菌16S定量と真菌28S定量PCRで先進医療にて行われています。








